PC/PD données

Données pharmacocinétiques et pharmacodynamiques chez des patients atteints de pneumonie et bénéficiant d’une ventilation mécanique
Étude prospective, multicentrique, ouverte, de phase1
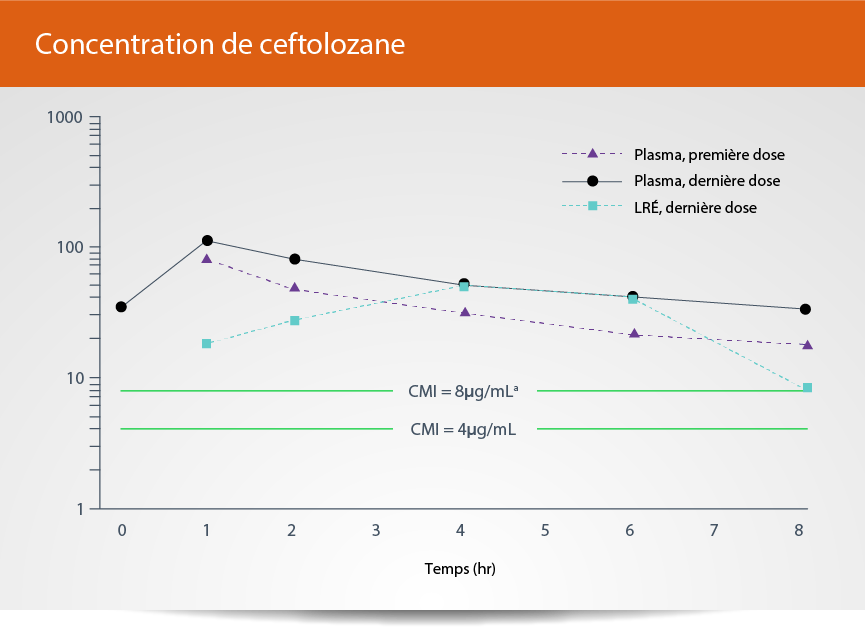
ZERBAXA® 3 g a atteint des concentrations thérapeutiques supérieures à la CMI dans
l’LRÉ tout au long de l’intervalle de dosage
Objectif:
- Caractériser la pharmacocinétique plasmatique, la pénétration intrapulmonaire et l’innocuité de ZERBAXA® 3 g chez des patients gravement malades atteints de pneumonie recevant une ventilation mécanique.
Conception de l’étude¹ :
- Une étude prospective, ouverte, multicentrique, de Phase 1, visant à caractériser la pharmacocinétique (PK), la sécurité et la tolérance du ceftolozane/tazobactam chez des adultes en état critique, avec deux cohortes de patients, a été réalisée. Les résultats de la première cohorte, composée de patients sous ventilation mécanique recevant simultanément une antibiothérapie standard pour une pneumonie avérée ou suspectée, ont été rapportés. Les patients ont été recrutés dans 10 sites d’étude (principalement des unités de soins intensifs médicaux ou chirurgicaux) en Belgique, en Espagne et aux États-Unis entre mai 2015 et juin 2017.
- Les patients inclus étaient âgés de ≥18 ans, souffraient d’une pneumonie avérée ou suspectée, étaient hospitalisés en unité de soins intensifs (USI) et recevaient une ventilation mécanique depuis ≥24 heures avant leur inclusion. Ils devaient également être susceptibles de rester sous ventilation mécanique pendant ≥8 heures après la dernière dose du médicament à l’étude. La pneumonie avérée ou suspectée était définie par la présence d’au moins un des critères suivants : fièvre (température corporelle >38,5 °C), hypothermie (température corporelle <35,0 °C), leucocytose (nombre de leucocytes ≥12 000 cellules/mm³) ou radiographie thoracique montrant des caractéristiques évocatrices de pneumonie. Les patients devaient également recevoir une antibiothérapie pour leur pneumonie au moment de l’inclusion et être susceptibles de continuer cette thérapie pendant la durée de l’étude.
- Les critères d’exclusion incluaient : un taux d’hémoglobine de base <7 g/dL ; une insuffisance rénale terminale, définie par un CLCR <15 mL/min (calculé selon l’équation de Cockcroft–Gault basée sur le poids corporel réel) et/ou la nécessité d’une épuration rénale continue ou d’une hémodialyse ; l’administration antérieure (24 heures avant la première dose de l’étude) ou concomitante de piperacilline/tazobactam, de ceftolozane/tazobactam hors étude ou de probénécide ; ou des conditions pouvant interférer avec l’évaluation ou l’interprétation de la pharmacocinétique (par exemple, mucoviscidose, exacerbation aiguë de bronchite chronique ou de maladie obstructive des voies respiratoires, maladie respiratoire chronique sévère, tuberculose pulmonaire active ou greffe pulmonaire).
- Les patients éligibles ont reçu entre quatre et six doses de ceftolozane/tazobactam administrées toutes les 8 heures par perfusion intraveineuse de 60 minutes. La posologie a été ajustée en fonction de la fonction rénale : 3 g de ceftolozane/tazobactam (2 g de ceftolozane et 1 g de tazobactam) pour les patients avec un CLCR >50 mL/min ; 1,5 g (1 g de ceftolozane et 500 mg de tazobactam) pour les patients avec un CLCR entre 30 et 50 mL/min ; et 750 mg (500 mg de ceftolozane et 250 mg de tazobactam) pour les patients avec un CLCR entre 15 et 29 mL/min. Le CLCR était calculé une fois par jour, à heure fixe, pendant le traitement à l’étude. Les patients recevant le régime le plus faible de ceftolozane/tazobactam devaient recevoir six doses pour atteindre des concentrations plasmatiques à l’état d’équilibre, tandis que pour les autres patients, le nombre de doses était laissé à la discrétion de l’investigateur pour faciliter le moment du lavage broncho-alvéolaire (BAL). Les patients ont été assignés aléatoirement à un moment précis pour subir une bronchoscopie et un BAL (du segment pulmonaire identifié comme siège de la pneumonie) à 1 (±30 min), 2 (±30 min), 4 (±30 min), 6 (±30 min) ou 8 (±30 min) heures après le début de la dernière perfusion du médicament à l’étude (n = 5 par intervalle de temps).
- La sécurité et la tolérance ont été évaluées tout au long de l’étude en examinant les événements indésirables (EI), les modifications des résultats des tests de laboratoire clinique et les variations des signes vitaux. Les EI ont été collectés tout au long de l’étude jusqu’à 24 à 48 heures après la dernière dose du médicament à l’étude.
Adapté de Caro L, Nicolau DP, De Waele JJ, et al. Lung penetration, bronchopulmonary pharmacokinetic/pharmacodynamic profile and safety of 3 g of ceftolozane/tazobactam administered to ventilated, critically ill patients with pneumonia.J Antimicrob Chemother. 2020;75(6):1546-1553. Available at https://academic.oup.com/jac/article-abstract/75/6/1546/5811380.
© Les auteurs 2020. http://creativecommons.org/licenses/by/4.0/
aLa CMI du ceftolozane non lié pour P. aeruginosa intermédiairement sensible est de 8 μg/mL.
bLa CMI du ceftolozane non lié pour P. aeruginosa est de 4 μg/mL.
LRÉ, liquide de revêtement épithélial; CMI, concentration minimale inhibitrice; P. aeruginosa, Pseudomonas aeruginosa.
Bibliographie:
- Caro L, et al. J Antimicrob Chemother. 2020;75(6):1546-1553.
DZ-ZER-00040. Date d’expiration : 24-1-2026.